LA QUÍMICA

Se denomina química (del árabe kēme (kem, كيمياء), que significa 'tierra') a la ciencia que estudia tanto la composición, estructura y propiedades de la materia como los cambios que ésta experimenta durante las reacciones químicas y su relación con la energía. Históricamente la química moderna es la evolución de la alquimia tras la Revolución química (1733).
Las disciplinas de la química se han agrupado según la clase de materia bajo estudio o el tipo de estudio realizado. Entre éstas se tienen la química inorgánica, que estudia la materia inorgánica; la química orgánica, que trata con la materia orgánica; la bioquímica, el estudio de substancias en organismos biológicos; la físico-química, que comprende los aspectos energéticos de sistemas químicos a escalas macroscópicas, moleculares y atómicas; la química analítica, que analiza muestras de materia y trata de entender su composición y estructura. Otras ramas de la química han emergido en tiempos recientes, por ejemplo, la neuroquímica estudia los aspectos químicos del cerebro.
CUADRO DE LA QUIMICA ORGANICA E INORGANICA:
SUBDICIPLINAS DE LA QUIMICA:
nanoquímica (relacionada con la nanotecnología)
geoquímica: estudia todas las transformaciones de los minerales existentes en la tierra.
química macromolecular: estudia la preparación, caracterización, propiedades y aplicaciones de las macromoléculas o polímeros;
química medioambiental: estudia la influencia de todos los componentes químicos que hay en la tierra, tanto en su forma natural como antropogénica;
CONCEPTOS FUNDAMENTALES:
Partículas
Los átomos son las partes más pequeñas de un elemento (como el carbono, el hierro o el oxígeno).
Todos los átomos de un mismo elemento tienen la misma estructura
electrónica (responsable ésta de la mayor parte de las características
químicas), y pueden diferir en la cantidad de neutrones (isótopos). Las moléculas son las partes más pequeñas de una sustancia (como el azúcar), y se componen de átomos enlazados entre sí. Si tienen carga eléctrica, tanto átomos como moléculas se llaman iones: cationes si son positivos, aniones si son negativos.
El mol se usa como contador de unidades, como la docena (12) o el millar (1000), y equivale a 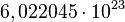 . Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar
de un elemento está basada en la masa de un mol de dicho elemento). Se
dice entonces que el mol es una unidad de cambio. El mol tiene relación
directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amedeo Avogadro,
Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente,
equivale al número de partículas presentes en 1 mol de dicha sustancia:
. Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar
de un elemento está basada en la masa de un mol de dicho elemento). Se
dice entonces que el mol es una unidad de cambio. El mol tiene relación
directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amedeo Avogadro,
Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente,
equivale al número de partículas presentes en 1 mol de dicha sustancia:
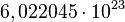 . Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar
de un elemento está basada en la masa de un mol de dicho elemento). Se
dice entonces que el mol es una unidad de cambio. El mol tiene relación
directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amedeo Avogadro,
Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente,
equivale al número de partículas presentes en 1 mol de dicha sustancia:
. Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar
de un elemento está basada en la masa de un mol de dicho elemento). Se
dice entonces que el mol es una unidad de cambio. El mol tiene relación
directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amedeo Avogadro,
Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente,
equivale al número de partículas presentes en 1 mol de dicha sustancia:
Dentro de los átomos pueden existir un núcleo atómico y uno o más electrones.
Los electrones son muy importantes para las propiedades y las
reacciones químicas. Dentro del núcleo se encuentran los neutrones y los
protones. Los electrones se encuentran alrededor del núcleo. También se
dice que el átomo es la unidad básica de la materia con características
propias. Está formado por un núcleo, donde se encuentran protones.
DE LAS MOLECULAS A LOS ATOMOS
Los enlaces
son las uniones entre átomos para formar moléculas. Siempre que existe
una molécula es porque ésta es más estable que los átomos que la forman
por separado. A la diferencia de energía entre estos dos estados se le denomina energía de enlace.
Generalmente los átomos se combinan en proporciones fijas para generar moléculas. Por ejemplo, dos átomos de hidrógeno se combinan con uno de oxígeno para dar una molécula de agua. Esta proporción fija se conoce como estequiometría.
TABLA PERIÓDICA
La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características; su función principal es establecer un orden específico agrupando elementos.
Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La forma actual es una versión modificada de la de Mendeléyev; fue diseñada por Alfred Werner.
NOMENCLATURA QUÍMICA
En un sentido amplio, nomenclatura química son las reglas y regulaciones que rigen la designación (la identificación o el nombre) de las sustancias químicas.
Como punto inicial para su estudio es necesario distinguir primero entre compuestos orgánicos e inorgánicos.
Los compuestos orgánicos son los que contienen carbono, comúnmente enlazado con hidrógeno, oxígeno, boro, nitrógeno, azufre y algunos halógenos. El resto de los compuestos se clasifican como compuestos inorgánicos. Éstos se nombran según las reglas establecidas por la IUPAC.
Nomenclatura en química inorgánica
Los compuestos inorgánicos se clasifican según la función química que contengan y por el número de elementos químicos que los forman, con reglas de nomenclatura particulares para cada grupo.
Una función química es la tendencia de una sustancia a reaccionar de manera semejante en presencia de otra. Por ejemplo, los compuestos ácidos tienen propiedades característica de la función ácido, debido a que todos ellos tienen el ion H+1; y las bases tienen propiedades características de este grupo debido al ion OH-1 presente en estas moléculas
Debemos recordar aquí que las principales funciones químicas son: óxidos, bases, ácidos y sales.
Ver: Compuestos inorgánicos
Actualmente se aceptan tres sistemas o subsistemas de nomenclatura, estos son:
el sistema de nomenclatura estequiométrica o sistemático,
el sistema de nomenclatura funcional o clásico o tradicional y
el sistema de nomenclatura Stock.
Estos tres sistemas nombran a casi todos los compuestos inorgánicos, siendo la nomenclatura tradicional la más extensa.
Algunas reglas para la nomenclatura inorgánica
Se escribe siempre en primer lugar el símbolo del elemento o radical menos electronegativo (menor capacidad de atraer electrones) y a continuación el del elemento o radical más electronegativo (mayor capacidad de atraer electrones). Pero se nombran en orden inverso a este orden.
Por ejemplo, CrBr3 = tribromuro de cromo; CO = monóxido de carbono
Se intercambian las valencias de los elementos o los radicales, colocándolas en forma de subíndices. Estos subíndices se simplifican, si se puede, teniendo en cuenta que deben ser números enteros y que el 1 no se escribe.
En los ejemplos anteriores: CrBr3
El cromo está actuando con valencia 3 (Cr+3) y el bromo lo hace con valencia –1 (Br–1) (el cromo puede tener valencia 2,3,4,5,6 y el bromo puede tener valencia +1, –1, 3, 5, 7)
La fórmula sería Cr+3 Br–1, intercambiamos las valencias pero poniendo su número como subíndice y queda CrBr3 (sería Cr1, pero el uno no se escribe).
La Unión Internacional de Química Pura y Aplicada (IUPAC) recomienda el uso de la nomenclatura sistemática, la más extendida, y la de Stock o funcional, utilizada sobre todo para nombrar óxidos, hidruros y hidróxidos.
En la nomenclatura sistemática de los óxidos la palabra genérica óxido va precedida de los prefijos griegos mono-, di-, tri-, tetra-, penta-, hexa- o hepta-, según el número de oxígenos que existan; a continuación se indica, de la misma forma, la proporción del segundo elemento.
Por ejemplo, N2O5, pentaóxido de dinitrógeno (5 átomos de oxígeno y 2 átomos de nitrógeno).
En algunas ocasiones se puede prescindir del prefijo mono- (CaO, óxido de calcio).
En la nomenclatura de Stock no se utilizan prefijos. Los óxidos se nombran con la palabra óxido seguida del nombre del otro elemento y su valencia entre paréntesis; siguiendo con el ejemplo: N2O5, sería óxido de nitrógeno (V). Si el elemento que se combina con el oxígeno tiene valencia única, no es necesario indicarla; así, Li2O es óxido de litio (de la misma fórmula deducimos que la valencia del litio es 1 y la del oxígeno 2).
En los hidruros metálicos el hidrógeno actúa con valencia –1 y se nombran con la palabra genérica hidruro seguida del nombre del metal. El número de átomos de hidrógeno se indica mediante prefijos numerales; por ejemplo, AuH3, trihidruro de oro.
En la nomenclatura funcional se nombran con la palabra hidruro seguida del nombre del metal y su valencia correspondiente, salvo que la valencia sea única [AuH3, hidruro de oro (III)].
En los hidruros no metálicos el hidrógeno actúa con valencia +1 y los no metales con sus respectivas valencias negativas; se nombran añadiendo el sufijo -uro al no metal. Por ejemplo, HCl, cloruro de hidrógeno.
Los hidróxidos se nombran con la palabra hidróxido seguida del nombre del metal, indicando con prefijos numerales sus proporciones; por ejemplo, Mg(OH)2, dihidróxido de magnesio.
En la nomenclatura de Stock no se utilizan los prefijos: al nombre del metal se le añade su valencia, aunque ésta se omite cuando es única; por ejemplo, Mg(OH)2, hidróxido de magnesio.
En la nomenclatura sistemática, los ácidos oxoácidos se nombran como compuestos binarios en los que el constituyente negativo (anión) es poliatómico; se utiliza el sufijo -ato para el anión y se especifica la valencia del elemento central mediante números romanos entre paréntesis, seguida de la palabra hidrógeno; por ejemplo, HClO, oxoclorato (I) de hidrógeno. Para estos ácidos, la IUPAC admite la nomenclatura tradicional (HClO, ácido hipocloroso).
Ver videos con ejemplos sobre nomenclatura inorgánica:
Nomenclatura en química orgánica
El sistema para nombrar actualmente los compuestos orgánicos, conocido como sistema IUPAC, se basa en una serie de reglas muy sencillas que permiten nombrar cualquier compuesto orgánico a partir de su fórmula desarrollada, o viceversa. Esta es lanomenclatura sistemática. Además existe la nomenclatura vulgar, que era el nombre por el que se conocían inicialmente muchas moléculas orgánicas (como por ejemplo ácido acético, formaldehído, estireno, colesterol, etcétera), y que hoy día está aceptada.
El nombre sistemático está formado por un prefijo, que indica el número de átomos de carbono que contiene la molécula, y unsufijo, que indica la clase de compuesto orgánico de que se trata.
Algunos de los prefijos más utilizados son:
| Átomos de C |
Prefijo
|
1
|
Met-
|
2
|
Et-
|
3
|
Prop-
|
4
|
But-
|
5
|
Pent-
|
6
|
Hex-
|
7
|
Hept-
|
8
|
Oct-
|
9
|
Non-
|
10
|
Dec-
|
Ahora veremos como se nombran las distintas familias de compuestos orgánicos.
En aquellos casos en los que se conozca el nombre vulgar, se incluirá al lado del nombre sistemático.
Hidrocarburos
Son aquellos compuestos orgánicos que contienen únicamente carbono (C) e hidrógeno (H) en su molécula.
Existen dos grupos principales de hidrocarburos, los alifáticos y los aromáticos, cada uno de los cuales se subdividen a su vez en varias clases de compuestos:
• Alifáticos: Dentro de este grupo están los alcanos, alquenos, alquinos y cicloalcanos
• Aromáticos: Existen dos clases de compuestos, los monocíclicos o mononucleares, que contienen sólo un núcleo bencénico y los policíclicos o polinucleares que contienen dos o más núcleos bencénicos.
Alcanos. Responden a la fórmula general CnH2n+2. Son hidrocarburos acíclicos (no tienen ciclos en su cadena) saturados (tienen el máximo número de hidrógenos posible).
- Alcanos de cadena lineal. Se nombran utilizando uno de los prefijos de la tabla anterior seguido del sufijo -ano.
Ejemplos:
| CH4 | metano |
| C2H6 | etano |
| C3H8 | propano |
| C4H10 | butano |
| C5H12 | pentano |
| C6H14 | hexano |
Ver: PSU; Química,
Alcanos de cadena ramificada. Para nombrar estos compuestos hay que seguir los siguientes pasos:
Buscar la cadena hidrocarbonada más larga y ésta constituye el hidrocarburo principal, que nombra al compuesto y que llevará la terminación -ano si es un alcano. Si hay más de una cadena con la misma longitud se elige como principal aquella que tiene mayor número de cadenas laterales.
Se numeran los átomos de carbono empezando por el extremo más próximo a un carbono con sustituyentes (radicales) y éstos se nombran anteponiéndoles un número localizador que indica su posición en la cadena, seguido de un guión.
Si existen dos sustituyentes en el mismo átomo de carbono, se repite el número separado por una coma. Cuando hay dos o más sustituyentes diferentes en el compuesto se nombran por orden alfabético. Por ejemplo 4,5-dietil-2,2,7-trimetildecano.
Para ver más sobre alcanos, ir a Nomenclatura y numeración de cadenas.
Alquenos y alquinos
Para nombrar los alquenos o los alquinos se toma como cadena principal la más larga que contenga el doble o triple enlace y se termina en -eno o -ino; su posición se indica con el número localizador más bajo posible y tiene preferencia sobre las cadenas laterales al numerar los carbonos.
Otros compuestos
Los alcoholes se nombran añadiendo la terminación -ol al hidrocarburo e indicando con el localizador más bajo posible la posición que ocupa el grupo -OH.
En los aldehídos se sustituye la terminación -o de los hidrocarburos por -al y la cadena se comienza a numerar por el extremo que lleva el grupo carbonilo (C=O).
Las cetonas se nombran cambiando la terminación -o del hidrocarburo por -ona, y la posición del grupo carbonilo se indica con un localizador.
En los ácidos carboxílicos se antepone la palabra ácido a la del hidrocarburo del que proceden, en el que la terminación -o se sustituye por -oico.
Las aminas se nombran añadiendo al nombre del radical el sufijo -amina. Si un mismo radical está repetido dos o tres veces se le anteponen los prefijos di- o tri-. Si la amina lleva radicales diferentes se nombran por orden alfabético.
Las amidas cambian la terminación -oico del ácido por el sufijo -amida.
Los nitrilos se pueden considerar derivados del cianuro de hidrógeno, H-CN, al sustituir el átomo de hidrógeno por radicales alquilo. Se nombran añadiendo el sufijo -nitrilo al nombre de la cadena principal.
Fuente Internet:
Para ampliar el tema:
Fuente Internet y texto completo:
Además, se puede consultar:
Es propiedad: www.profesorenlinea.cl. Registro Nº 188.540


No hay comentarios:
Publicar un comentario